BENTUK MOLEKUL
Bentuk
molekul (geometri molekul) adalah posisi atom dalam molekul. Ikatan kimia dalam
suatu molekul pada awalnya dijelaskan sebagai interaksi atom melalui ikatan
kovalen, yaitu berbagi elektron valensi untuk mencapai konfigurasi elektron gas
mulia. Dengan berdasar dari Teori Mekanika Kuantum, Walter Heitler dan Fritz
London (1927) menggambarkan elektron valensi berbagi sebagai interaksi
orbital atom dalam bentuk tumpang tindih orbital. Kemudian, ini menjadi dasar
teori ikatan kimia, dikenal sebagai Teori Ikatan Valensi.
- Teori Ikatan Valensi
Tumpang
tindih orbital atom
Dalam
teori ikatan valensi, ikatan kovalen digambarkan sebagai tumpang tindih orbital
atom. Pada ikatan kovalen normal, tumpang tindih melibatkan dua setengah penuh
atom orbital (masing-masing berisi 1 elektron valensi). Posisi tumpang tindih
adalah seperti untuk mencapai energi potensial minimum, yang identik dengan
ikatan terkuat.
Salah
satu teori yang sering digunakan untuk meramalkan bentuk molekul adalah Valence-Shell
Electron-Pair Repulsion atau VSEPR. Teori ini tidak menggunakan
orbital atom sama sekali. Untuk menentukan bentuk molekul, teori ini
menggunakan pasangan elektron di sekitar atom pusat, khususnya tolakan antara
setiap pasangan elektron. Pasangan elektron dalam molekul akan menempati orbital
itu sendiri sehingga akan ada gaya tolakan minimum. Untuk memiliki daya tolakan
minimal, pasangan elektron menempati orbital dalam jarak yang jauh. Bentuk
molekul dalam pembahasan sebelumnya ditinjau pada atom pusat yang tidak memiliki
pasangan elektron bebas. What if the central atom has one or more lone pairs of
electrons? Bagaimana jika atom pusat memiliki satu atau lebih pasangan elektron
bebas?
Menurut
lambang Lewis, selain sepasang elektron digunakan berikatan, juga digambarkan
pasangan elektron yang tidak berikatan. Pasangan elektron yang tidak digunakan
untuk berikatan disebut pasangan
elektron bebas (PEB). Penjelasan mengenai pasangan bebas telah kita temukan
pada saat membahas ikatan kovalen koordinasi di kelas X. Dengan demikian, ada
dua jenis pasangan elektron dalam molekul, yaitu pasangan elektron yang
digunakan untuk berikatan (PEI) dan pasangan elektron bebas (PEB).
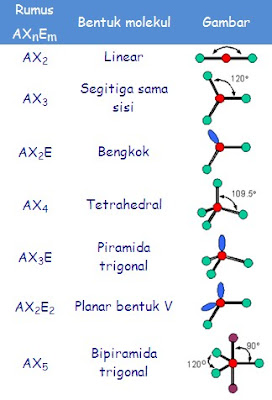
Untuk
menentukan jumlah pasangan elektron, kita harus mampu menggambarkan struktur Lewis. Tabel 2 menunjukkan geometri
molekul yang atom pusatnya memiliki pasangan elektron bebas. Untuk
menyederhanakan, rumus molekul yang memiliki pasangan elektron bebas ditulis
sebagai ABxEy, dengan A pusat atom, B sebagai atom yang
terikat dengan atom pusat dan E sebagai pasangan elektron bebas. Sementara itu
x menunjukkan jumlah atom terikat dengan atom pusat, nilai x = 2,3,.... Nilai y
menunjukkan jumlah pasangan elektron bebas yang dimiliki atom pusat, nilai y =
1,2, ....